- Margarita Franco Asencio
- Cristhel Reyes Perez.
30/9/09
BIENVENIDA!!
ESTEREOQUIMICA
La ciencia de la química orgánica, como hemos dicho, se basa en la relación entre estructura molecular y propiedades. Aquella parte de la ciencia que se ocupa de la estructura en tres dimensiones La estereoquímica es el estudio de los compuestos orgánicos en el espacio
Estereoisomeria
Estereoisomeros
Isomeros
La isomería es el fenómeno mediante el cual dos o más compuestos diferentes se representan por medio de fórmulas moleculares idénticas. Las moléculas isómeras poseen diferentes propiedades físicas y químicas, y estas diferencias se atribuyeron a la existencia de fórmulas moleculares distintas. Los compuestos que poseen la misma fórmula molecular, pero diferentes fórmulas estructurales, reciben el nombre de isómeros (del griego, iso, igual; meros, parte).
Isomeros Estructurales
Forma de isomería, donde las moléculas con la misma formula molecular, tienen un diferente arreglo en los enlaces entre sus átomos, es lo opuesto a los estereoisómeros.
Debido a esto se pueden presentar 3 diferentes modos de isomería:
• Isomería de cadena o esqueleto.- Los isómeros de este tipo, tienen componentes de la cadena acomodados en diferentes lugares.
Un ejemplo es el pentano, del cual, existen muchos isómeros, pero los más conocidos son el isopentano y el neopentano
• Isomería de posición.- En donde, los grupos funcionales de un compuestos, se unen de diferentes posiciones.
Un ejemplo simple de este tipo de isomería es la molécula del pentanol, donde e 3-pentanol.
• Isomería de grupo funcional.- Aquí, la diferente conectividad de los átomos, pueden generar diferentes grupos funcionales en la cadena. Un ejemplo es el ciclohexano y el 1-hexeno, que tienen la misma fórmula molecular (C6H12), pero el ciclohexano es un alcano cíclico o cicloalcano y el 1-hexeno es un alqueno. Hay varios ejemplos de isomeria como la de ionización,coordinación,enlace,geometría y óptica.
Isomeros Geometricos
Son estereoisomeros que no pueden convertirse uno en otro sin que se rompa un enlace química, esto se presentan en pares y utilizan los términos Cis y Trans
Son el tipo específico de diasteromeros que deben su existencia a la rotación impedida en torno del enlace carbono-carbono ( C- C )
La isomería cis-trans o geométrica es debida a la rotación restringida entorno a un enlace carbono-carbono.
Esta restricción puede ser debida a la presencia de dobles enlaces o ciclos. Así, el 2-buteno puede existir en forma de dos isómeros, llamados cis y trans.
ISOMERO CIS
Significa que dos atomos en particulares son adyacentes que están del mismo lado del doble enlace o en la misma cara
ISOMERO TRANS
Cuando dos grupos de 2 atomos existen de lado opuesto de la formula estructural
Isomeros Opticos
Son imágenes que no se pueden superponer (se dice que la imagen del isómero se puede superponer cuando la estructura se empalma con otra y coinciden todos sus lados, al igual que los geométricos, estos se presentan en pares.
Dextrogiro
Cuando un compuesto ópticamente activo, rota la luz polarizada en el sentido de las agujas del reloj, se dice que es dextrógiro y se representa por (+).
Diastereoisomeros
Son una clase de estereoisómeros tales, que no son superponibles pero tampoco imagen especular uno del otro, es decir, no son enantiómeros.
Los diastereoisómeros difieren en sus propiedades físicas y químicas.
Dentro del grupo de los diasterómeros se encuentran los Isomeros cis - trans (antes conocido como Isómeros Geometricos), los confórmeros isómeros conformacionales y, en las moléculas con varios centros quirales, los isómeros que pertenecen a distintas parejas de enantiómeros
Enantiomero y la Luz Polarizada
- Enantiómeros
En la ciencia de la química se dice que dos estereoisómeros son enantiómeros si la imagen especular de uno no puede ser superpuesta con la del otro. Dicho de otra forma: un enantiómero es una imagen especular no superponible de sí mismola imagen especular de uno no puede ser superpuesta con la del otro. Dicho de otra forma: un enantiómero es una imagen especular no superponible de sí mismo. Tienen las mismas propiedades físicas y químicas, excepto por la interacción con el plano de la luz polarizada o con otras moléculas quirales.
- Un Enantiomero y la luz polarizada
Cuando la luz polarizada pasa a través de una cubeta que contiene una sustancia quiral, se produce una rotación en el plano de polarización.
Las sustancias quirales rotan la luz polarizada y se dice de ellas que son ópticamente activas (presentan actividad óptica). Aquellas sustancias que no producen rotación en la luz polarizada son ópticamente inactivas.
- Luz Polarizada
La luz normal consiste en ondas electromagnéticas que vibran en todas las direcciones. Cuando la luz pasa a través de un polarizador (prisma de Nicol) las ondas electromagnéticas vibran en un plano. Este plano de oscilación coincide con el plano de propagación de la onda.
29/9/09
Quiralidad Molecular
Proyeccion de Fischer
Proyectar consiste en dibujar en dos dimensiones (plano) una molécula. En la proyección de Fischer la molécula se dibuja en forma de cruz con los sustituyentes que van al fondo del plano en la vertical y los grupos que salen hacia nosotros en la horizontal, el punto intersección de ambas líneas representa el carbono proyectado.
Paso de Newman a Fischer
Para convertir proyecciones de Newman en proyecciones de Fischer se dibuja la forma espacial de la molécula, disponiéndola en conformación eclipsada para hacer la proyección de Fischer.
Nomenclatura De los Antiomeros
Es necesaria una nomenclatura que distinga los estereoisómeros de una molécula. Así, en el caso del 2-Clorobutano la notación debe distinguir un enantiómero del otro. Cahn, Ingold y Prelog desarrollaron unas reglas que permiten distinguir unos estereoisómeros de otros, y que a continuación describo.
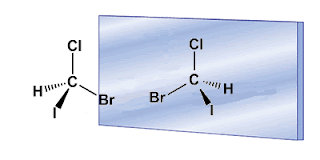
Regla 1.- Dar prioridades a cada uno de los cuatro átomos o grupos de átomos enlazados directamente al carbono asimétrico. Esta prioridad se da por número atómico. En la moléculade Bromocloroyodometano, el yodo es el grupo de mayor prioridad, que representamos por “a” y el hidrógeno el de menor prioridad, que respresentamos por “d”.
Regla 2.- Orientar la molécula con el grupo de menor prioridad hacia el fondo del papel. En el ejemplo anterior el grupo de menor prioridad es el hidrógeno (grupo d) y está como puede verse en la figura al fondo del papel (línea discontinua). Ahora dibujamos una flecha que recorre los grupos en orden a → b → c. Si el recorrido es en el sentido de las agujas del reloj, el carbono asimétrico tiene notación R. Si el recorrido es en sentido contrario la configuración del carbono es S.

Definiciones
| Rotación específica.- Es el número observado de grados de rotación. Quiralidad.- Es la presencia de un átomo de carbono con cuatro átomos o grupos diferentes unidos a él. Molécula quiral.- Se dice que una molécula es quiral si puede escribirse de dos formas que sean una la imagen especular de la otra. Centro quiral.- Es un átomo unido a cuatro grupos diferentes(puede ser Carbono, Nitrógeno, Fósforo, etc). Superponible.- Que se puede acomodar (espacialmente) en una forma idéntica a otro compuesto isómero. Compuesto meso.- Son compuestos que tienen varios carbonos asimétricos y planos de simetría, estos son ópticamente inactivos. Modificación racémica.- Es una mezcla equimolecular de enantiómeros del mismo compuesto y que al mezclarse pierden su actividad óptica, se representan con (± ). Configuración e isómeros configuracionales.- Las configuraciones son las disposiciones relativas cuando para una misma constitución existe más de una posible disposición espacial, isomeros configuracionales son los estereoisómeros como los diastereómeros y los enantiómeros. Isomeros conformacionales.- Son las conformaciones diferentes que corresponden a mínimos de energía, también denominados confórmeros. Polarímetro.- Es un aparato que sirve para medir el grado de rotación del plano de la luz polarizada |
Conclusiones
- Hay que pensar que la molécula armada es solo una de las tantas formas que puede adoptar una molécula.
- Podemos concluir que de todos los confórmeros posibles, la molécula adoptara la mayor parte de tiempo solo un de ellos. La molécula buscara la conformación mas cómoda o mas estable, o sea la conformación en donde las interacciones sean mínimas.
- Para cada compuesto nuevo que se descubre sería bueno tratar de llevarlo a modelos moleculares ya que no podría dar una ayuda acerca de los efectos estéricos que pueda tener en relación con otras moléculas adyacentes.
- Actualmente se vienen des cubriendo infinidad de compuestos y de cadena o anillos muy grandes lo que hace prácticamente imposible hacer su correspondiente modelo molecular.


.jpg)